2-MBT
Gries, W., Küpper, K., Leng, G., 2015. Rapid and sensitive LC-MS-MS determination of 2-mercaptobenzothiazole, a rubber additive, in human urine. Anal Bioanal Chem 407, 12, 3417-3423, https://doi.org/10.1007/s00216-015-8533-5.
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Murawski, A., Schmied-Tobies, M.I.H., Schwedler, G., Rucic, E., Gries, W., Schmidtkunz, C., Küpper, K., Leng, G., Conrad, A., Kolossa-Gehring, M., 2020. 2-Mercaptobenzothiazole in urine of children and adolescents in Germany - Human biomonitoring results of the German Environmental Survey 2014-2017 (GerES V). Int J Hyg Environ Health 228, 113540, https://doi.org/10.1016/j.ijheh.2020.113540.
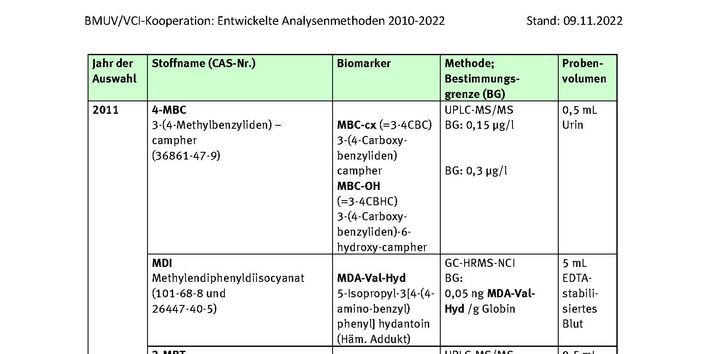
4-MBC
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Murawski, A., Schmied-Tobies, M.I.H., Rucic, E., Schmidtkunz, C., Küpper, K., Leng, G., Eckert, E., Kuhlmann, L., Göen, T., Daniels, A., Schwedler, G., Kolossa-Gehring, M., 2021. Metabolites of 4-methylbenzylidene camphor (4-MBC), butylated hydroxytoluene (BHT), and tris(2-ethylhexyl) trimellitate (TOTM) in urine of children and adolescents in Germany - human biomonitoring results of the German Environmental Survey GerES V (2014-2017). Environ Res 192, 110345, https://doi.org/10.1016/j.envres.2020.110345.
7-Hydroxycitronellal
Pluym, N., Petreanu, W., Weber, T., Scherer, G., Scherer, M., Kolossa-Gehring, M., 2020. Biomonitoring data on young adults from the Environmental Specimen Bank suggest a decrease in the exposure to the fragrance chemical 7-hydroxycitronellal in Germany from 2000 to 2018. Int J Hyg Environ Health 227, 113508, https://doi.org/10.1016/j.ijheh.2020.113508.
Stoeckelhuber, M., Krnac, D., Pluym, N., Scherer, M., Leibold, E., Scherer, G., 2017. A validated UPLC-MS/MS method for biomonitoring the exposure to the fragrance 7-hydroxycitronellal. J Chromatogr B Analyt Technol Biomed Life Sci 1068-1069, 261-267, https://doi.org/10.1016/j.jchromb.2017.10.040.
Stoeckelhuber, M., Krnac, D., Pluym, N., Scherer, M., Peschel, O., Leibold, E., Scherer, G., 2018. Human metabolism and excretion kinetics of the fragrance 7-hydroxycitronellal after a single oral or dermal dosage. Int J Hyg Environ Health 221, 2, 239-245, https://doi.org/10.1016/j.ijheh.2017.10.015.
Alkylphenole
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Ringbeck, B., Belov, V.N., Schmidtkunz, C., Küpper, K., Gries, W., Weiss, T., Brüning, T., Hayen, H., Bury, D., Leng, G., Koch, H.M., 2021. Human Metabolism and Urinary Excretion Kinetics of Nonylphenol in Three Volunteers after a Single Oral Dose. Chem Res Toxicol 34, 11, 2392-2403, https://doi.org/10.1021/acs.chemrestox.1c00301.
Ringbeck, B., Bury, D., Hayen, H., Weiss, T., Brüning, T., Koch, H.M., 2021. Determination of specific urinary nonylphenol metabolites by online-SPE-LC-MS/MS as novel human exposure biomarkers. J Chromatogr B Analyt Technol Biomed Life Sci 1177, 122794, https://doi.org/10.1016/j.jchromb.2021.122794.
Ringbeck, B., Weber, T., Bury, D., Kasper-Sonnenberg, M., Pälmke, C., Brüning, T., Koch, H.M., Kolossa-Gehring, M., 2022. Nonylphenol (NP) exposure in Germany between 1991 and 2021: Urinary biomarker analyses in the German Environmental Specimen Bank (ESB). Int J Hyg Environ Health 245, 114010, https://doi.org/10.1016/j.ijheh.2022.114010.
BHT
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Murawski, A., Schmied-Tobies, M.I.H., Rucic, E., Schmidtkunz, C., Küpper, K., Leng, G., Eckert, E., Kuhlmann, L., Göen, T., Daniels, A., Schwedler, G., Kolossa-Gehring, M., 2021. Metabolites of 4-methylbenzylidene camphor (4-MBC), butylated hydroxytoluene (BHT), and tris(2-ethylhexyl) trimellitate (TOTM) in urine of children and adolescents in Germany - human biomonitoring results of the German Environmental Survey GerES V (2014-2017). Environ Res 192, 110345, https://doi.org/10.1016/j.envres.2020.110345.
Schmidtkunz, C., Küpper, K., Weber, T., Leng, G., Kolossa-Gehring, M., 2020. A biomonitoring study assessing the exposure of young German adults to butylated hydroxytoluene (BHT). Int J Hyg Environ Health 228, 113541, https://doi.org/10.1016/j.ijheh.2020.113541.
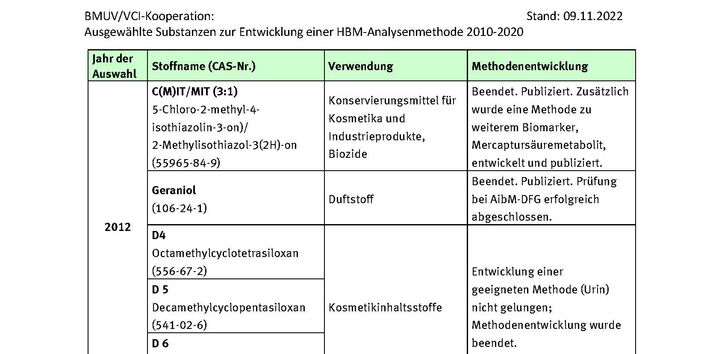
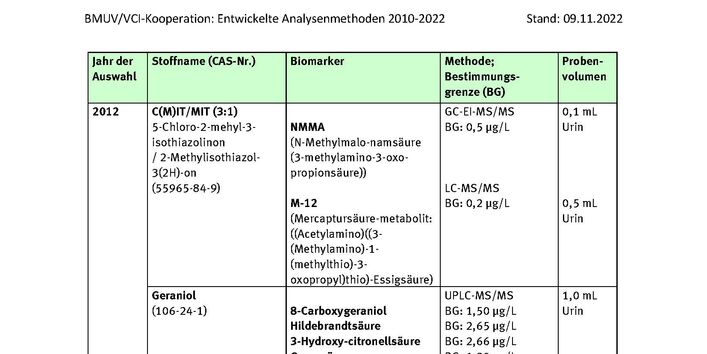
CIT/MIT
Murawski, A., Schmied-Tobies, M.I.H., Rucic, E., Schettgen, T., Bertram, J., Conrad, A., Kolossa-Gehring, M., 2020. The methylisothiazolinone and methylchloroisothiazolinone metabolite N-methylmalonamic acid (NMMA) in urine of children and adolescents in Germany - Human biomonitoring results of the German Environmental Survey 2014-2017 (GerES V). Int J Hyg Environ Health 227, 113511, https://doi.org/10.1016/j.ijheh.2020.113511.
Schettgen, T., Bertram, J., Kraus, T., 2017. Quantification of N-methylmalonamic acid in urine as metabolite of the biocides methylisothiazolinone and chloromethylisothiazolinone using gas chromatography-tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 1044-1045, 185-193, https://doi.org/10.1016/j.jchromb.2017.01.019.
Schettgen, T., Bertram, J., Kraus, T., 2021. New data on the metabolism of chloromethylisothiazolinone and methylisothiazolinone in human volunteers after oral dosage: excretion kinetics of a urinary mercapturic acid metabolite ("M-12"). Arch Toxicol 95, 8, 2659-2665, https://doi.org/10.1007/s00204-021-03100-5.
Schettgen, T., Bertram, J., Weber, T., Kraus, T., Kolossa-Gehring, M., 2021. Quantification of a mercapturate metabolite of the biocides methylisothiazolinone and chloromethylisothiazolinone ("M-12") in human urine using online-SPE-LC/MS/MS. Anal Methods 13, 15, 1847-1856, https://doi.org/10.1039/d1ay00183c.
Schettgen, T., Kraus, T., 2017. Urinary excretion kinetics of the metabolite N-methylmalonamic acid (NMMA) after oral dosage of chloromethylisothiazolinone and methylisothiazolinone in human volunteers. Arch Toxicol 91, 12, 3835-3841, https://doi.org/10.1007/s00204-017-2051-5.
Schettgen, T., Rüther, M., Weber, T., Kraus, T., Kolossa-Gehring, M., 2020. N-methylmalonamic acid (NMMA) as metabolite of methylisothiazolinone and methylchloroisothiazolinone in 24-h urine samples of the German Environmental Specimen Bank from 2000 to 2017 - exposure and time trends. Chemosphere 246, 125743, https://doi.org/10.1016/j.chemosphere.2019.125743.
Climbazol
Schmidtkunz, C., Küpper, K., Gries, W., Leng, G., 2021. A validated LC-MS/MS method for the quantification of climbazole metabolites in human urine. J Chromatogr B Analyt Technol Biomed Life Sci 1173, 122677, https://doi.org/10.1016/j.jchromb.2021.122677.
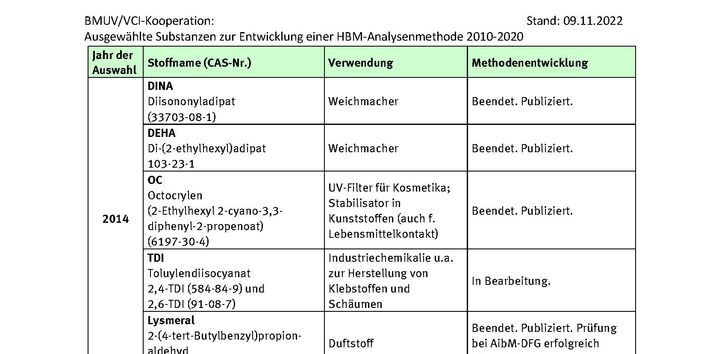
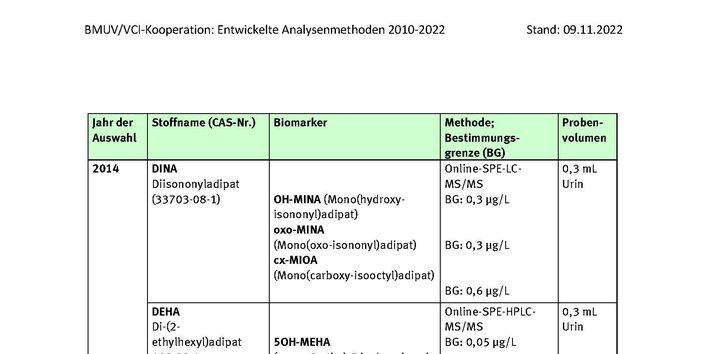
DEHA
Nehring, A., Bury, D., Kling, H.W., Weiss, T., Brüning, T., Koch, H.M., 2019. Determination of human urinary metabolites of the plasticizer di(2-ethylhexyl) adipate (DEHA) by online-SPE-HPLC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1124, 239-246, https://doi.org/10.1016/j.jchromb.2019.06.019.
Nehring, A., Bury, D., Ringbeck, B., Kling, H.W., Otter, R., Weiss, T., Brüning, T., Koch, H.M., 2020. Metabolism and urinary excretion kinetics of di(2-ethylhexyl) adipate (DEHA) in four human volunteers after a single oral dose. Toxicol Lett 321, 95-102, https://doi.org/10.1016/j.toxlet.2019.12.006.
DEHTP
Lessmann, F., Kolossa-Gehring, M., Apel, P., Rüther, M., Pälmke, C., Harth, V., Brüning, T., Koch, H.M., 2019. German Environmental Specimen Bank: 24-hour urine samples from 1999 to 2017 reveal rapid increase in exposure to the para-phthalate plasticizer di(2-ethylhexyl) terephthalate (DEHTP). Environ Int 132, 105102, https://doi.org/10.1016/j.envint.2019.105102.
Lessmann, F., Schütze, A., Weiss, T., Brüning, T., Koch, H.M., 2016. Determination of metabolites of di(2-ethylhexyl) terephthalate (DEHTP) in human urine by HPLC-MS/MS with on-line clean-up. J Chromatogr B Analyt Technol Biomed Life Sci 1011, 196-203, https://doi.org/10.1016/j.jchromb.2015.12.042.
Lessmann, F., Schütze, A., Weiss, T., Langsch, A., Otter, R., Brüning, T., Koch, H.M., 2016. Metabolism and urinary excretion kinetics of di(2-ethylhexyl) terephthalate (DEHTP) in three male volunteers after oral dosage. Arch Toxicol 90, 7, 1659-1667, https://doi.org/10.1007/s00204-016-1715-x.
Schwedler, G., Rucic, E., Koch, H.M., Lessmann, F., Brüning, T., Conrad, A., Schmied-Tobies, M.I.H., Kolossa-Gehring, M., 2020. Metabolites of the substitute plasticiser Di-(2-ethylhexyl) terephthalate (DEHTP) in urine of children and adolescents investigated in the German Environmental Survey GerES V, 2014-2017. Int J Hyg Environ Health 230, 113589, https://doi.org/10.1016/j.ijheh.2020.113589.
DINA
Gotthardt, A., Bury, D., Kling, H.W., Otter, R., Weiss, T., Brüning, T., Koch, H.M., 2021. Quantitative investigation of the urinary excretion of three specific monoester metabolites of the plasticizer diisononyl adipate (DINA). EXCLI J 20, 412-425, https://doi.org/10.17179/excli2021-3360.
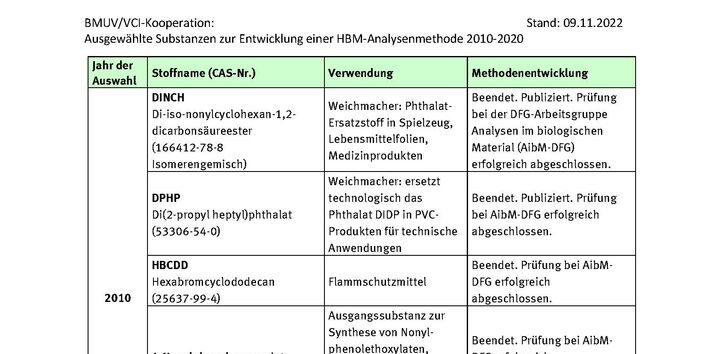
DINCH
Kasper-Sonnenberg, M., Koch, H.M., Apel, P., Rüther, M., Pälmke, C., Brüning, T., Kolossa-Gehring, M., 2019. Time trend of exposure to the phthalate plasticizer substitute DINCH in Germany from 1999 to 2017: Biomonitoring data on young adults from the Environmental Specimen Bank (ESB). Int J Hyg Environ Health 222, 8, 1084-1092, https://doi.org/10.1016/j.ijheh.2019.07.011.
Koch, H.M., Schütze, A., Pälmke, C., Angerer, J., Brüning, T., 2013. Metabolism of the plasticizer and phthalate substitute diisononyl-cyclohexane-1,2-dicarboxylate (DINCH((R))) in humans after single oral doses. Arch Toxicol 87, 5, 799-806, https://doi.org/10.1007/s00204-012-0990-4.
Schütze, A., Kolossa-Gehring, M., Apel, P., Brüning, T., Koch, H.M., 2014. Entering markets and bodies: increasing levels of the novel plasticizer Hexamoll(R) DINCH(R) in 24 h urine samples from the German Environmental Specimen Bank. Int J Hyg Environ Health 217, 2-3, 421-426, https://doi.org/10.1016/j.ijheh.2013.08.004.
Schütze, A., Lorber, M., Gawrych, K., Kolossa-Gehring, M., Apel, P., Brüning, T., Koch, H.M., 2015. Development of a multi-compartment pharmacokinetic model to characterize the exposure to Hexamoll(R) DINCH(R). Chemosphere 128, 216-224, https://doi.org/10.1016/j.chemosphere.2015.01.056.
Schütze, A., Otter, R., Modick, H., Langsch, A., Brüning, T., Koch, H.M., 2017. Additional oxidized and alkyl chain breakdown metabolites of the plasticizer DINCH in urine after oral dosage to human volunteers. Arch Toxicol 91, 1, 179-188, https://doi.org/10.1007/s00204-016-1688-9.
Schütze, A., Pälmke, C., Angerer, J., Weiss, T., Brüning, T., Koch, H.M., 2012. Quantification of biomarkers of environmental exposure to di(isononyl)cyclohexane-1,2-dicarboxylate (DINCH) in urine via HPLC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 895-896, 123-130, https://doi.org/10.1016/j.jchromb.2012.03.030.
Schwedler, G., Conrad, A., Rucic, E., Koch, H.M., Leng, G., Schulz, C., Schmied-Tobies, M.I.H., Kolossa-Gehring, M., 2020. Hexamoll(R) DINCH and DPHP metabolites in urine of children and adolescents in Germany. Human biomonitoring results of the German Environmental Survey GerES V, 2014-2017. Int J Hyg Environ Health 229, 113397, https://doi.org/10.1016/j.ijheh.2019.09.004.
DnBA
Ringbeck, B., Bury, D., Gotthardt, A., Hayen, H., Otter, R., Weiss, T., Brüning, T., Koch, H.M., 2021. Human metabolism and urinary excretion kinetics of di-n-butyl adipate (DnBA) after oral and dermal administration in three volunteers. Toxicol Lett 343, 11-20, https://doi.org/10.1016/j.toxlet.2021.02.012.
Ringbeck, B., Bury, D., Hayen, H., Weiss, T., Brüning, T., Koch, H.M., 2020. Determination of di-n-butyl adipate (DnBA) metabolites as possible biomarkers of exposure in human urine by online-SPE-LC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1141, 122029, https://doi.org/10.1016/j.jchromb.2020.122029.
DPHP
Gries, W., Ellrich, D., Küpper, K., Ladermann, B., Leng, G., 2012. Analytical method for the sensitive determination of major di-(2-propylheptyl)-phthalate metabolites in human urine. J Chromatogr B Analyt Technol Biomed Life Sci 908, 128-136, https://doi.org/10.1016/j.jchromb.2012.09.019.
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Leng, G., Koch, H.M., Gries, W., Schütze, A., Langsch, A., Brüning, T., Otter, R., 2014. Urinary metabolite excretion after oral dosage of bis(2-propylheptyl) phthalate (DPHP) to five male volunteers--characterization of suitable biomarkers for human biomonitoring. Toxicol Lett 231, 2, 282-288, https://doi.org/10.1016/j.toxlet.2014.06.035.
Schmidtkunz, C., Gries, W., Weber, T., Leng, G., Kolossa-Gehring, M., 2019. Internal exposure of young German adults to di(2-propylheptyl) phthalate (DPHP): Trends in 24-h urine samples from the German Environmental Specimen Bank 1999-2017. Int J Hyg Environ Health 222, 3, 419-424, https://doi.org/10.1016/j.ijheh.2018.12.008.
Schütze, A., Gries, W., Kolossa-Gehring, M., Apel, P., Schröter-Kermani, C., Fiddicke, U., Leng, G., Brüning, T., Koch, H.M., 2015. Bis-(2-propylheptyl)phthalate (DPHP) metabolites emerging in 24h urine samples from the German Environmental Specimen Bank (1999-2012). Int J Hyg Environ Health 218, 6, 559-563, https://doi.org/10.1016/j.ijheh.2015.05.007.
Schwedler, G., Conrad, A., Rucic, E., Koch, H.M., Leng, G., Schulz, C., Schmied-Tobies, M.I.H., Kolossa-Gehring, M., 2020. Hexamoll(R) DINCH and DPHP metabolites in urine of children and adolescents in Germany. Human biomonitoring results of the German Environmental Survey GerES V, 2014-2017. Int J Hyg Environ Health 229, 113397, https://doi.org/10.1016/j.ijheh.2019.09.004.
EHS
Bury, D., Brüning, T., Koch, H.M., 2019. Determination of metabolites of the UV filter 2-ethylhexyl salicylate in human urine by online-SPE-LC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1110-1111, 59-66, https://doi.org/10.1016/j.jchromb.2019.02.014.
Bury, D., Griem, P., Wildemann, T., Brüning, T., Koch, H.M., 2019. Urinary metabolites of the UV filter 2-Ethylhexyl salicylate as biomarkers of exposure in humans. Toxicol Lett 309, 35-41, https://doi.org/10.1016/j.toxlet.2019.04.001.
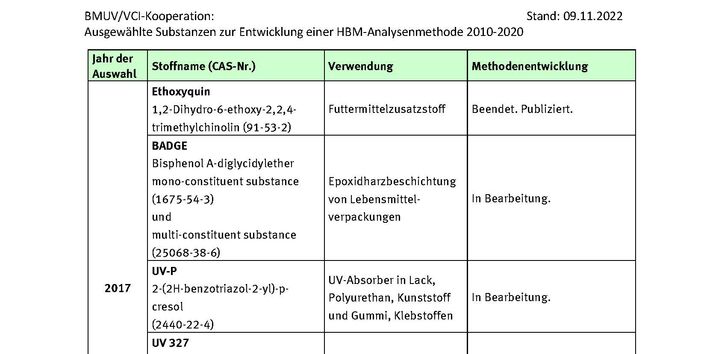
Ethoxyquin
Stoeckelhuber, M., Scherer, M., Bracher, F., Peschel, O., Leibold, E., Scherer, G., Pluym, N., 2020. Development of a human biomonitoring method for assessing the exposure to ethoxyquin in the general population. Arch Toxicol 94, 12, 4209-4217, https://doi.org/10.1007/s00204-020-02871-7.
Geraniol
Jäger, T., Bäcker, S., Brodbeck, T., Bader, M., Scherer, G., Stöckelhuber, M., Göen, T., Hartwig, A., Geraniol–Determination of 8‑carboxy‑geraniol, Hildebrandt acid, geranic acid, and 3‑hydroxycitronellic acid in urine by UPLC‑MS/MS. https://doi.org/10.34865/bi10624e6_3or.
Jäger, T., Bäcker, S., Brodbeck, T., Leibold, E., Bader, M., 2020. Quantitative determination of urinary metabolites of geraniol by ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Analytical Methods 12, 47, 5718-5728, https://doi.org/10.1039/D0AY01582B.
Pluym, N., Stockelhuber, M., Weber, T., Scherer, G., Scherer, M., Kolossa-Gehring, M., 2022. Time trend of the exposure to geraniol in 24-h urine samples derived from the German Environmental Specimen Bank from 2004 to 2018. Int J Hyg Environ Health 239, 113880, https://doi.org/10.1016/j.ijheh.2021.113880.
HBCDD
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
Homosalat
Ebert, K.E., Belov, V.N., Weiss, T., Brüning, T., Hayen, H., Koch, H.M., Bury, D., 2021. Determination of urinary metabolites of the UV filter homosalate by online-SPE-LC-MS/MS. Anal Chim Acta 1176, 338754, https://doi.org/10.1016/j.aca.2021.338754.
Lysmeral, Lilial
Murawski, A., Fiedler, N., Schmied-Tobies, M.I.H., Rucic, E., Schwedler, G., Stoeckelhuber, M., Scherer, G., Pluym, N., Scherer, M., Kolossa-Gehring, M., 2020. Metabolites of the fragrance 2-(4-tert-butylbenzyl)propionaldehyde (lysmeral) in urine of children and adolescents in Germany - Human biomonitoring results of the German Environmental Survey 2014-2017 (GerES V). Int J Hyg Environ Health 229, 113594, https://doi.org/10.1016/j.ijheh.2020.113594.
Pluym, N., Krnac, D., Gilch, G., Scherer, M., Leibold, E., Scherer, G., 2016. A liquid chromatography-tandem mass spectrometry (LC-MS/MS) method for the human biomonitoring of non-occupational exposure to the fragrance 2-(4-tert-butylbenzyl)propionaldehyde (lysmeral). Anal Bioanal Chem 408, 21, 5873-5882, https://doi.org/10.1007/s00216-016-9702-x.
Scherer, M., Koch, H.M., Schütze, A., Pluym, N., Krnac, D., Gilch, G., Leibold, E., Scherer, G., 2017. Human metabolism and excretion kinetics of the fragrance lysmeral after a single oral dosage. Int J Hyg Environ Health 220, 2 Pt A, 123-129, https://doi.org/10.1016/j.ijheh.2016.09.005.
Scherer, M., Petreanu, W., Weber, T., Scherer, G., Pluym, N., Kolossa-Gehring, M., 2021. Human biomonitoring in urine samples from the Environmental Specimen Bank reveals a decreasing trend over time in the exposure to the fragrance chemical lysmeral from 2000 to 2018. Chemosphere 265, 128955, https://doi.org/10.1016/j.chemosphere.2020.128955.
MDI
Gries, W., Leng, G., 2013. Analytical determination of specific 4,4'-methylene diphenyl diisocyanate hemoglobin adducts in human blood. Anal Bioanal Chem 405, 23, 7205-7213, https://doi.org/10.1007/s00216-013-7171-z.
Leng, G., Gries, W., 2017. New specific and sensitive biomonitoring methods for chemicals of emerging health relevance. Int J Hyg Environ Health 220, 2 Pt A, 113-122, https://doi.org/10.1016/j.ijheh.2016.09.014.
NMP/NEP
Koch, H.M., Bader, M., Weiss, T., Koslitz, S., Schütze, A., Kafferlein, H.U., Brüning, T., 2014. Metabolism and elimination of N-ethyl-2-pyrrolidone (NEP) in human males after oral dosage. Arch Toxicol 88, 4, 893-899, https://doi.org/10.1007/s00204-013-1150-1.
Schmied-Tobies, M.I.H., Murawski, A., Rucic, E., Schwedler, G., Bury, D., Kasper-Sonnenberg, M., Koslitz, S., Koch, H.M., Brüning, T., Kolossa-Gehring, M., 2021. Alkyl pyrrolidone solvents N-methyl-2-pyrrolidone (NMP) and N-ethyl-2-pyrrolidone (NEP) in urine of children and adolescents in Germany - human biomonitoring results of the German Environmental Survey 2014-2017 (GerESV). Environ Int 146, 106221, https://doi.org/10.1016/j.envint.2020.106221.
Ulrich, N., Bury, D., Koch, H.M., Rüther, M., Weber, T., Kafferlein, H.U., Weiss, T., Brüning, T., Kolossa-Gehring, M., 2018. Metabolites of the alkyl pyrrolidone solvents NMP and NEP in 24-h urine samples of the German Environmental Specimen Bank from 1991 to 2014. Int Arch Occup Environ Health 91, 8, 1073-1082, https://doi.org/10.1007/s00420-018-1347-y.
Octocrylen
Bury, D., Belov, V.N., Qi, Y., Hayen, H., Volmer, D.A., Brüning, T., Koch, H.M., 2018. Determination of Urinary Metabolites of the Emerging UV Filter Octocrylene by Online-SPE-LC-MS/MS. Anal Chem 90, 1, 944-951, https://doi.org/10.1021/acs.analchem.7b03996.
Bury, D., Modick-Biermann, H., Leibold, E., Brüning, T., Koch, H.M., 2019. Urinary metabolites of the UV filter octocrylene in humans as biomarkers of exposure. Arch Toxicol 93, 5, 1227-1238, https://doi.org/10.1007/s00204-019-02408-7.
Phenoxyethanol
Jäger, T., Eckert, E., Leibold, E., Bader, M., 2022. Reliable determination of the main metabolites of 2-phenoxyethanol in human blood and urine using LC-MS/MS analysis. Anal Methods, https://doi.org/10.1039/d2ay01407f.
TDCPP
Krystek, P., Beeltje, H., Noteboom, M., van den Hoeven, E.M., Houtzager, M.M.G., 2019. Analytical human biomonitoring method for the identification and quantification of the metabolite BDCPP originated from the organophosphate flame retardant TDCPP in urine. J Pharm Biomed Anal 170, 169-175, https://doi.org/10.1016/j.jpba.2019.03.036.
TOTM, TEHTM
Höllerer, C., Becker, G., Göen, T., Eckert, E., 2018. Human metabolism and kinetics of tri-(2-ethylhexyl) trimellitate (TEHTM) after oral administration. Arch Toxicol 92, 9, 2793-2807, https://doi.org/10.1007/s00204-018-2264-2.
Höllerer, C., Becker, G., Göen, T., Eckert, E., 2018. Regioselective ester cleavage of di-(2-ethylhexyl) trimellitates by porcine liver esterase. Toxicol In Vitro 47, 178-185, https://doi.org/10.1016/j.tiv.2017.11.015.
Höllerer, C., Göen, T., Eckert, E., 2018. Comprehensive monitoring of specific metabolites of tri-(2-ethylhexyl) trimellitate (TEHTM) in urine by column-switching liquid chromatography-tandem mass spectrometry. Anal Bioanal Chem 410, 18, 4343-4357, https://doi.org/10.1007/s00216-018-1086-7.
Höllerer, C., Müller, J., Göen, T., Eckert, E., 2017. Isomeric separation and quantitation of di-(2-ethylhexyl) trimellitates and mono-(2-ethylhexyl) trimellitates in blood by LC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1061-1062, 153-162, https://doi.org/10.1016/j.jchromb.2017.07.014.
Kuhlmann, L., Göen, T., Eckert, E., 2021. Sensitive monitoring of the main metabolites of tri-(2-ethylhexyl) trimellitate (TOTM) in urine by coupling of on-line SPE, UHPLC and tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 1171, 122618, https://doi.org/10.1016/j.jchromb.2021.122618.
Murawski, A., Schmied-Tobies, M.I.H., Rucic, E., Schmidtkunz, C., Küpper, K., Leng, G., Eckert, E., Kuhlmann, L., Göen, T., Daniels, A., Schwedler, G., Kolossa-Gehring, M., 2021. Metabolites of 4-methylbenzylidene camphor (4-MBC), butylated hydroxytoluene (BHT), and tris(2-ethylhexyl) trimellitate (TOTM) in urine of children and adolescents in Germany - human biomonitoring results of the German Environmental Survey GerES V (2014-2017). Environ Res 192, 110345, https://doi.org/10.1016/j.envres.2020.110345.
UV 327
Fischer, C., Göen, T., 2021. Determination of UV-327 and its metabolites in human urine using dispersive liquid-liquid microextraction and gas chromatography-tandem mass spectrometry. Anal Methods 13, 35, 3978-3986, https://doi.org/10.1039/d1ay00932j.
Fischer, C., Göen, T., 2022. Development and Validation of a DLLME–GC–MS/MS Method for the Determination of Benzotriazole UV Stabilizer UV-327 and Its Metabolites in Human Blood. Journal of Analytical Toxicology, https://doi.org/10.1007/s00204-022-03401-3.
Fischer, C., Leibold, E., Göen, T., 2020. Identification of in vitro phase I metabolites of benzotriazole UV stabilizer UV-327 using HPLC coupled with mass spectrometry. Toxicol In Vitro 68, 104932, https://doi.org/10.1016/j.tiv.2020.104932.
Fischer, C., Leibold, E., Hiller, J., Göen, T., 2022. Human metabolism and excretion kinetics of benzotriazole UV stabilizer UV-327 after single oral administration. Arch Toxicol, https://doi.org/10.1007/s00204-022-03401-3.
UV 328 (Tinuvin 328)
Denghel, H., Göen, T., 2020. Determination of the UV absorber 2-(2H-benzotriazol-2-yl)-4,6-di-tert-pentylphenol (UV 328) and its oxidative metabolites in human urine by dispersive liquid-liquid microextraction and GC-MS/MS. J Chromatogr B Analyt Technol Biomed Life Sci 1144, 122071, https://doi.org/10.1016/j.jchromb.2020.122071.
Denghel, H., Göen, T., 2021. Dispersive liquid-liquid microextraction (DLLME) and external real matrix calibration for the determination of the UV absorber 2-(2H-benzotriazol-2-yl)-4,6-di-tert-pentylphenol (UV 328) and its metabolites in human blood. Talanta 223, Pt 1, 121699, https://doi.org/10.1016/j.talanta.2020.121699.
Denghel, H., Hiller, J., Leibold, E., Göen, T., 2021. Human metabolism and kinetics of the UV absorber 2-(2H-benzotriazol-2-yl)-4,6-di-tert-pentylphenol (UV 328) after oral administration. Arch Toxicol 95, 8, 2677-2690, https://doi.org/10.1007/s00204-021-03093-1.
Denghel, H., Leibold, E., Göen, T., 2019. Oxidative phase I metabolism of the UV absorber 2-(2H-benzotriazol-2-yl)-4,6-di-tert-pentylphenol (UV 328) in an in vitro model with human liver microsomes. Toxicol In Vitro 60, 313-322, https://doi.org/10.1016/j.tiv.2019.06.012.
Uvinul A Plus
Stoeckelhuber, M., Pluym, N., Bracher, F., Leibold, E., Scherer, G., Scherer, M., 2019. A validated UPLC-MS/MS method for the determination of urinary metabolites of Uvinul(R) A plus. Anal Bioanal Chem 411, 30, 8143-8152, https://doi.org/10.1007/s00216-019-02201-6.
Stoeckelhuber, M., Scherer, M., Peschel, O., Leibold, E., Bracher, F., Scherer, G., Pluym, N., 2020. Human metabolism and urinary excretion kinetics of the UV filter Uvinul A plus(R) after a single oral or dermal dosage. Int J Hyg Environ Health 227, 113509, https://doi.org/10.1016/j.ijheh.2020.113509.